
[한의신문=김대영 기자] 지난해 의약품 허가‧신고 현황의 특징은 △‘새로운 제형’ 형태의 제품개발 증가 △국내 개발 ‘개량신약’ 및 ‘바이오시밀러’ 개발 상승 추세 △ ‘신경계용의약품’의 강세 등으로 나타났다.
식품의약품안전처(처장 이의경)이 지난 28일 발간한 지난해 의약품 허가·신고 현황을 담은 ‘2019년 의약품 허가 보고서’에 따르면 지난해 새로운 제형(71개 품목, 38.8%)의 국내 개발이 두드러졌다.
기존의 ‘캡슐제’를 정제 등 다른 ‘경구용 제제’로 개발하거나 ‘현탁용 분말’을 ‘산제’로 개발한 경우가 많았으며 특히 ‘일반(속방성)제제’를 약의 복용 횟수를 줄여 편의성을 높인 ‘서방성제제’로 개발한 경우가 강세를 보였다.
다만 특허 회피 전략 등으로 활용되는 ‘새로운 염’ 또는 ‘이성체’ 의약품(2개 품목, 1.1%) 개발은 큰 폭으로 감소했는데(2018년대비 91.7% 감소) 이는 특허 회피 전략 필요성 감소와 식약처의 개량신약 불인정 등의 영향이란 분석이다.
신약은 지난해 35개 품목이 허가됐으며 이 중 국내 신약은 4개 품목, 수입 신약은 31개 품목으로 제품 특성별로는 화학의약품 28개 품목, 생물의약품 7개 품목이다.
신약 허가는 전년 대비 증가했으며 국내 개발 개량신약과 바이오시밀러도 꾸준히 개발되고 있는 것으로 조사됐다.
화학의약품 신약 중 국내(4개 품목)는 전이성 결장직장암 치료와 파킨슨 증후군 치료제 각 2개 품목, 생물의약품 신약의 경우 모두 수입(7개 품목)으로 백혈병치료제, 골다공증치료제 등이 허가됐다.
약효군별로 분류하면 해열·진통·소염제 등이 포함된 ‘신경계용의약품’이 1070개 품목(22.2%)으로 가장 많이 허가됐다.
이는 18년(19.5%) 대비 약 2.7% 증가한 것으로 해열 또는 진통제와 치매치료제 등 중추신경용약의 지속적인 증가에 따른 것이란 분석이다.
신경계용의약품에 이어 혈압강하제 등 ‘순환계용의약품’ 902개 품목(18.8%), ‘소화 기관용의약품’ 545개 품목(11.3%), ‘기타의 대사성의약품’ 및 ‘당뇨병용제’ 437개 품목(9.1%), ‘항생물질제제’ 267개 품목(5.6%), ‘화학요법제’ 251개 품목(5.2%), ‘혈액 및 체액용약’ 230개 품목(4.8%), ‘알레르기용약’ 207개 품목(4.3%) 순이었다.
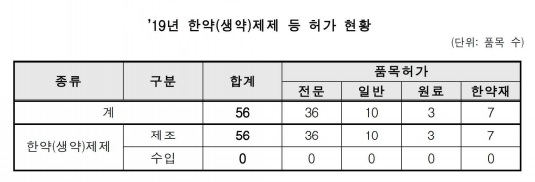
한약(생약)제제의 경우 지난해 허가된 품목은 56품목으로 전년 42품목 대비 33.3% 증가했다.
심사유형별로 분석해 보면 생물학적동등성 시험 등 동등성을 입증해 허가된 품목이 31품목으로 가장 많았으며 자료제출의약품 5품목, 한약서 수재 처방에 근거해 한방건강보험용의약품으로 허가된 제제가 10품목, 원료의약품 및 한약재가 각각 3품목과 7품목으로 집계됐다.
자료제출의약품 중에서는 새로운 조성이 1품목, 함량증감 2품목, 새로운 제형(연조엑스, 액제) 2품목, 새로운 제형(연조엑스, 액제) 2품목이었다.
의약품 분류기준에 따라 구분하면 전문의약품 36품목, 일반의약품 10품목, 원료의약품 3품목 및 한약재 7품목으로 나타났다.
전문의약품의 경우 ‘휴티렌투엑스정(애엽 95% 에탄올연조엑스(20→1))’ 등 10품목은 2015년 품목허가 된 ‘스티렌투엑스정(애엽95% 에탄올연조엑스(20→1))’의 제네릭의약품이며 효능‧효과는 ‘급성위염 및 만성위염에 따른 위점막 병변(짓무름, 출혈, 발적, 부종) 개선’이다.
이들 제품은 ‘한약(생약)제제 등의 품목허가‧신고에 관한 규정’ 제3조제1항제2호에 따라 대조약과의 ‘비교용출시험에 관한 자료’를 제출해 ‘안전성‧유효성에 관한 자료’ 심사를 받았다.
‘움카민플러스시럽’은 펠라고니움시도이데스11% 에탄올추출물(1→8~10) 및 아이비엽30% 에탄올엑스(5~7.5→1) 함유 복합제제로 ‘한약(생약)제제 등의 품목허가‧신고에 관한 규정’의 새로운 조성 및 규격의 생약제제 중 ‘새로운 조성의 복합제’에 해당하는 자료를 제출, ‘안전성‧유효성에 관한 자료’ 심사를 받았다.
‘한신메시아-에프액(상황균사체엑스)’는 기허가 품목과 제형이 상이한 품목으로 ‘한약(생약)제제 등의 품목허가‧신고에 관한 규정’의 동일한 투여경로 새로운 제형에 해당하는 자료로 ‘안전성‧유효성에 관한 자료’ 심사를 받았다.
‘유니일라정’ 등 4품목은 2012년 품목허가 된 ‘레일라정’의 제네릭의약품으로 효능‧효과는 ‘골관절증의 증상 완화’다.
‘한약(생약)제제 등의 품목허가‧신고에 관한 규정’ 제3조제1항제2호에 따라 대조약과의 ‘비교용출시험에 관한 자료’를 제출해 ‘안전성‧유효성에 관한 자료’ 심사를 받았다.
‘한풍열다한소탕엑스정(동의수세보원)’은 기허가 된 과립제의 제형변경에 해당하는 품목으로 기준 및 시험방법에 관한 잘죠 등을 제출해 허가됐다.
일반의약품은 한약서 수재 처방에 근거한 ‘단미엑스혼합’ 제제 8품목과 연조엑스로 제제화한 2품목이 허가받았다.
원료의약품으로는 ‘보락육계‧아선약‧소두구‧고추50%에탄올연조엑스(5→1), ’한풍쌍화탕연조엑스(3.31→1), ‘한솔감초연조엑스(2.0~2.5→1) 3품목이 허가됐다.
 속초1.2℃
속초1.2℃ -0.5℃
-0.5℃ 철원-1.8℃
철원-1.8℃ 동두천-0.4℃
동두천-0.4℃ 파주-0.5℃
파주-0.5℃ 대관령-4.6℃
대관령-4.6℃ 춘천1.4℃
춘천1.4℃ 백령도-0.5℃
백령도-0.5℃ 북강릉2.1℃
북강릉2.1℃ 강릉3.1℃
강릉3.1℃ 동해3.8℃
동해3.8℃ 서울0.0℃
서울0.0℃ 인천-0.7℃
인천-0.7℃ 원주-0.5℃
원주-0.5℃ 울릉도0.6℃
울릉도0.6℃ 수원0.1℃
수원0.1℃ 영월-0.8℃
영월-0.8℃ 충주-0.2℃
충주-0.2℃ 서산-0.4℃
서산-0.4℃ 울진4.1℃
울진4.1℃ 청주0.7℃
청주0.7℃ 대전0.3℃
대전0.3℃ 추풍령-1.9℃
추풍령-1.9℃ 안동0.3℃
안동0.3℃ 상주0.5℃
상주0.5℃ 포항3.4℃
포항3.4℃ 군산1.1℃
군산1.1℃ 대구1.8℃
대구1.8℃ 전주2.1℃
전주2.1℃ 울산2.4℃
울산2.4℃ 창원4.5℃
창원4.5℃ 광주1.3℃
광주1.3℃ 부산5.5℃
부산5.5℃ 통영4.9℃
통영4.9℃ 목포0.5℃
목포0.5℃ 여수2.8℃
여수2.8℃ 흑산도3.6℃
흑산도3.6℃ 완도2.3℃
완도2.3℃ 고창0.7℃
고창0.7℃ 순천-0.4℃
순천-0.4℃ 홍성(예)0.7℃
홍성(예)0.7℃ -0.3℃
-0.3℃ 제주6.1℃
제주6.1℃ 고산5.7℃
고산5.7℃ 성산6.3℃
성산6.3℃ 서귀포7.9℃
서귀포7.9℃ 진주4.3℃
진주4.3℃ 강화-0.5℃
강화-0.5℃ 양평1.0℃
양평1.0℃ 이천1.0℃
이천1.0℃ 인제-1.0℃
인제-1.0℃ 홍천-0.2℃
홍천-0.2℃ 태백-3.3℃
태백-3.3℃ 정선군-0.9℃
정선군-0.9℃ 제천-1.8℃
제천-1.8℃ 보은-0.6℃
보은-0.6℃ 천안0.2℃
천안0.2℃ 보령2.3℃
보령2.3℃ 부여1.7℃
부여1.7℃ 금산-0.5℃
금산-0.5℃ -0.3℃
-0.3℃ 부안1.8℃
부안1.8℃ 임실0.8℃
임실0.8℃ 정읍0.7℃
정읍0.7℃ 남원1.2℃
남원1.2℃ 장수-2.3℃
장수-2.3℃ 고창군0.2℃
고창군0.2℃ 영광군1.2℃
영광군1.2℃ 김해시5.2℃
김해시5.2℃ 순창군0.0℃
순창군0.0℃ 북창원4.9℃
북창원4.9℃ 양산시5.3℃
양산시5.3℃ 보성군2.8℃
보성군2.8℃ 강진군1.5℃
강진군1.5℃ 장흥1.6℃
장흥1.6℃ 해남2.2℃
해남2.2℃ 고흥2.7℃
고흥2.7℃ 의령군3.6℃
의령군3.6℃ 함양군1.4℃
함양군1.4℃ 광양시5.0℃
광양시5.0℃ 진도군2.8℃
진도군2.8℃ 봉화-2.1℃
봉화-2.1℃ 영주-1.2℃
영주-1.2℃ 문경-0.1℃
문경-0.1℃ 청송군-0.3℃
청송군-0.3℃ 영덕2.7℃
영덕2.7℃ 의성1.8℃
의성1.8℃ 구미2.1℃
구미2.1℃ 영천1.5℃
영천1.5℃ 경주시2.3℃
경주시2.3℃ 거창1.4℃
거창1.4℃ 합천4.1℃
합천4.1℃ 밀양4.0℃
밀양4.0℃ 산청1.1℃
산청1.1℃ 거제5.8℃
거제5.8℃ 남해4.1℃
남해4.1℃ 3.9℃
3.9℃






![[자막뉴스] 서울시 한의약 치매 건강증진사업, 어르신 건강 증진에 한 몫](https://www.akomnews.com/data/photo/2512/990852453_gWjQvmYX_208ec3d22cca3c4dabe0690736cb02fecca2d1b0.jpg)
![[자막뉴스] 국회와 정부, K-MEDI 동행 선언](https://www.akomnews.com/data/photo/2512/990852453_pWMfBulG_1f19604ef50b802d08e2eba88760392f36a0c023.jpg)
![[자막뉴스] '2025 한의혜민대상' 원성호 서울대 보건대학교 교수 대상](https://www.akomnews.com/data/photo/2512/990852453_9aoWOQ7J_f562bba0ac6cd1fa3cb3e0cfa693448832494455.jpg)
![[자막뉴스] 가천대 길한방병원 '전인 케어·통합암치료 결합 호스피스' 본격 시동](https://www.akomnews.com/data/photo/2512/990852453_KopJVa4A_3c6f4bbb06b1e87364c53423365ed86fb200850b.jpg)

![[여한의사회] "세계가 주목하는 침술의 힘"](https://www.akomnews.com/data/photo/2507/2039300137_tzacLJfB_2f59361a10063749b72d0e25ccb1a8ab9fe13f47.jpg)
























