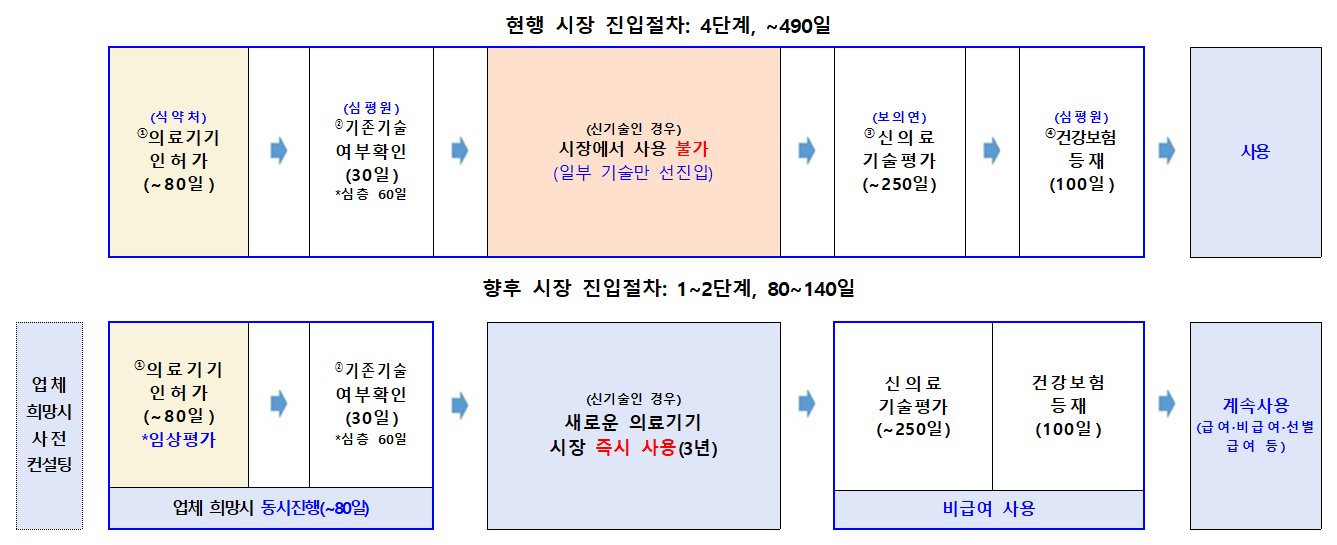
시장진입 기간 단축 및 절차 간소화 기대
[한의신문] 정부가 혁신적 의료기기가 식약처의 국제적 수준의 임상평가를 거친 경우, 별도의 신의료기술평가 없이 시장(의료현장)에 즉시 진입해 사용할 수 있도록 개선한다.
보건복지부(장관 정은경)와 식품의약품안전처(처장 오유경)는 26일 이 같은 내용의 ‘시장 즉시진입 의료기술’ 제도를 도입·시행한다고 밝혔다. 이 제도는 ‘신의료기술평가에 관한 규칙’ 및 ‘의료기기 허가·신고·심사 등에 관한 규정’ 개정 절차가 마무리돼 시행됐다.
신의료기술평가는 새로운 의료기술이 시장에 진입하기 위해 거쳐야 하는 절차로, 새 의료기술은 안정성·유효성을 검증받아야 의료현장 사용이 가능하다.
그간 의료기기 산업 활성화 및 우수한 의료기술의 신속한 시장 진입을 위해 평가를 유예하는 제도 등을 도입했지만, 현장에서는 절차가 복잡하고 평가에 오랜 시간이 소요돼 우수한 의료기술을 조기에 시장에 도입하고 활용하는 데 어려움이 있다는 지적이 제기돼 왔다.
이에 ‘신의료기술평가에 관한 규칙’ 및 ‘의료기기 허가·신고·심사 등에 관한 고시’를 동시 개정한 뒤, 식약처의 의료기기 허가 단계에서 국제적 수준의 강화된 임상평가를 거친 새로운 의료기기를 활용하는 의료기술은 별도의 신의료기술평가 없이 시장에 즉시 진입해 사용할 수 있도록 하는 제도를 마련했다.
이번 개정에 따라 국제적 수준의 강화된 임상평가를 거친 새로운 의료기기를 활용하는 새로운 의료기술은 시장에 즉시 진입할 수 있게 돼 최장 490일 소요되던 진입기간을 최단 80일까지로 단축할 수 있게 된다.
먼저 ‘신의료기술평가에 관한 규칙’ 개정 주요 내용에 따르면 △시장 즉시진입 의료기술은 혁신적 의료기술로 식약처 의료기기 허가 단계에서 강화된 임상평가를 거친 의료기기로 규정하고 △별도 신의료기술평가 없이 복지부장관이 시장 즉시진입 의료기술로 고시해 즉시 시장에서 사용할 수 있도록 했다. 단, 신의료기술평가 유예 신청자가 건강보험심사평가원에 시장 즉시진입 대상 의료기술의 기존기술 여부 확인을 신청해 기존 기술이 아님을 확인받아야 한다.
또 ‘의료기기 허가‧신고‧심사 등에 관한 규정’ 개정에 따르면 시장 즉시진입 대상 의료기기 품목을 공고하는 절차를 마련하고, 임상현장의 다양성과 안전성 검증 강화를 위한 임상평가자료 제출 근거 및 항목별 세부 내용 등을 규정했다.
아울러 식약처는 복지부와 협의를 거쳐 시장 즉시진입 의료기술의 대상이 되는 의료기기 품목으로 디지털의료기기, 체외진단의료기기, 의료용로봇 등 199개 품목 공고했다.
개정 관련 자세한 내용은 국가법령정보센터(www.law.go.kr) 또는 보건복지부 누리집(www.mohw.go.kr)→정보→법령, 식품의약품안전처 누리집(www.mfds.go.kr)→법령/자료→법령정보→고시훈령예규 에서 확인할 수 있다.
많이 본 뉴스
- 1 한의협, ‘한·양방 난임치료 공개토론회 개최’ 공식 제안
- 2 “시민중심 건강행정 빛났다…익산시 보건소 10관왕”
- 3 “당당하게 진료할 수 있는 기반을 마련하겠습니다”
- 4 “한의사 X-ray 사용 후속 행정조치…정원 30% 감축 즉시 필요”
- 5 조선의 히포크라테스 ‘유이태’의 생애 드라마로 부활 예정
- 6 “과감하지만 논리적”…한의 침 치료, 일본 침구계에 임상 철학 각인
- 7 국가 의료AI 데이터센터 추진…원주 거점으로 ‘소버린AI’ 속도전
- 8 한의사 X-ray·소방병원 한의과 추진…한병도 의원, 민주당 원내대표로 선출
- 9 ‘자보 개정안’ 재검토부터 재난·보훈까지…‘제도 밖’에서 ‘정책 안’으로
- 10 “막막하다는 한약 처방, 길을 제시하고 싶었다”